La disponibilità di medicinali a uso umano è sempre più minacciata dal fenomeno delle carenze, una criticità ormai ampiamente discussa nella comunità scientifica e che rappresenta un rischio concreto per la continuità terapeutica e la sicurezza dei pazienti.
Le cause alla base delle carenze sono molteplici e interconnesse: dalla mancanza di principi attivi alle politiche produttive orientate al contenimento dei costi, da problematiche regolatorie a questioni legate alla qualità del prodotto (ad esempio fuori specifica). A complicare ulteriormente il quadro si aggiungono le attuali tensioni geopolitiche internazionali — dazi, conflitti, incertezze nella fornitura energetica — che incidono in modo significativo su tutta la catena produttiva e logistica.
Il tema assume una valenza ancora più delicata se lo si lega ai principi di sostenibilità, sempre più centrali nel contesto globale anche attraverso l’adozione dei criteri ESG (Environmental, Social and Governance), volti a ridurre l’impatto delle attività umane e promuovere una governance responsabile.
In questo scenario, AFI – Associazione Farmaceutici dell’Industria – ha istituito un nuovo gruppo di studio con l’obiettivo di analizzare le cause profonde delle carenze e individuare strategie efficaci per prevenirle e mitigarne i rischi.
I risultati del lavoro, presentati durante il Simposio AFI di Rimini nel giugno 2025, vogliono supportare le aziende nello sviluppo di una visione consapevole e sistemica del fenomeno, offrendo strumenti per una gestione integrata delle carenze di medicinali. Il tema è cruciale non solo per l’industria, ma anche – e soprattutto – per le autorità regolatorie e i pazienti.
La rilevanza del tema è confermata anche dagli aggiornamenti normativi più recenti:
- Il DDL Semplificazioni 2025 [1], che propone una modifica all’obbligo – già introdotto dal “Decreto Calabria” (DL n. 35 del 30 aprile 2019) – di segnalazione ad AIFA di ogni possibile situazione di carenza da parte dei titolari di AIC (Autorizzazione all’Immissione in Commercio).
- La revisione del Capitolo 1 delle GMP (Good Manufacturing Practices), che nella versione in consultazione introduce riferimenti espliciti alla prevenzione delle carenze e all’approccio risk-based come guida alle decisioni aziendali [2].
Ogni azienda, attraverso strumenti consolidati come la FMEA (Failure Mode and Effects Analysis), può oggi valutare in modo proattivo le vulnerabilità della propria catena di fornitura, identificando le cause che potrebbero generare situazioni di carenza e definendo priorità di intervento.
Il gruppo di studio AFI ha applicato questo metodo con un approccio conservativo, attribuendo un punteggio fisso di gravità per uniformare la valutazione dei rischi e ottenere una mappatura chiara delle vulnerabilità. Il risultato è una razionalizzazione delle misure di mitigazione mirate, capace di garantire maggiore flessibilità operativa e un vantaggio competitivo, ma anche una più profonda consapevolezza delle responsabilità verso il sistema sanitario e i pazienti.
Contesto e analisi
La filiera farmaceutica è un sistema complesso e globale, composto da elementi interconnessi: pianificazione, approvvigionamento delle materie prime e dei materiali di confezionamento, produzione e distribuzione del prodotto finito. Ogni fase presenta sfide specifiche, che possono derivare sia da fattori intrinseci al processo sia da differenti priorità strategiche tra aziende o Paesi.
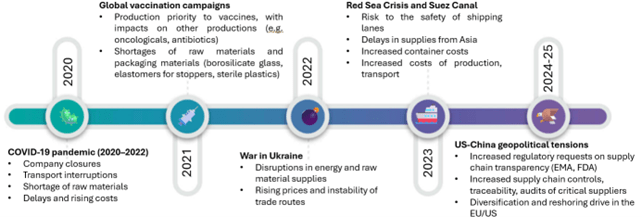
Non occorre andare troppo indietro nel tempo per comprendere quanto la supply chain sia stata – e continui a essere – sotto pressione. Alcuni esempi recenti lo dimostrano chiaramente:
-
La pandemia di COVID-19 ha messo a dura prova la capacità produttiva e logistica mondiale. Le campagne vaccinali del 2021 hanno spostato risorse e priorità verso la produzione dei vaccini, rallentando quella di altri medicinali essenziali, come antibiotici e antitumorali [3]. Le difficoltà nel reperire materie prime e componenti di confezionamento, unite alle chiusure temporanee di mercati strategici come la Cina, hanno mostrato la fragilità delle catene di approvvigionamento globali, spingendo l’Europa a ripensare le proprie strategie produttive.
-
La guerra in Ucraina (2022) ha ulteriormente evidenziato la vulnerabilità del sistema, interrompendo forniture energetiche e di materie prime, destabilizzando le rotte commerciali e facendo esplodere i costi di produzione e trasporto.
-
La crisi del Mar Rosso e del Canale di Suez (2023) ha ribadito la centralità delle vie marittime per il commercio internazionale [4]: i ritardi nelle forniture provenienti dall’Asia hanno inciso direttamente sulla disponibilità di principi attivi e materiali, aggravati dall’aumento dei costi di noli e container.
-
Le tensioni geopolitiche del 2025 hanno infine reso il contesto ancora più complesso: le autorità regolatorie (EMA, FDA) hanno introdotto requisiti più stringenti in materia di trasparenza e tracciabilità della supply chain, intensificando i controlli e spingendo molte aziende verso strategie di reshoring in Europa e negli Stati Uniti [5]. Parallelamente, dazi e nuove barriere commerciali minacciano la fluidità del commercio internazionale, con il rischio di far crescere i costi finali dei medicinali.
L’applicazione della metodologia FMEA
Per individuare in modo sistematico i punti di vulnerabilità della catena di fornitura, il gruppo di lavoro AFI ha applicato la metodologia FMEA all’intero processo produttivo e distributivo. Ogni “modo di guasto” è stato valutato in base a tre parametri – gravità, probabilità e rilevabilità – adottando un approccio prudenziale che attribuisce a tutti i prodotti lo stesso livello di gravità, per concentrare l’attenzione sulle cause radice e sulle strategie di prevenzione.

L’analisi ha consentito di distinguere due grandi categorie di rischio:
-
Rischi globali, legati a fattori esterni e sistemici (dazi, tensioni geopolitiche, chiusure di confini), al di fuori del controllo diretto dell’azienda;
-
Rischi locali, riconducibili a processi, decisioni operative o strategie aziendali, dunque potenzialmente gestibili con azioni mirate.
Rischi globali
Le cause globali richiedono un approccio coordinato tra i diversi stakeholder. L’analisi ha evidenziato la necessità di promuovere la cooperazione attraverso gruppi di lavoro interaziendali e canali di comunicazione aperti con le autorità competenti, per una risposta rapida nelle situazioni critiche. Tra le azioni suggerite: una gestione condivisa dei farmaci critici, la semplificazione dei processi regolatori e un approccio concertato alla tutela dei brevetti.
Rischi locali
Le criticità locali, invece, riguardano fattori interni: processi, strategie e decisioni operative.
Nel campo degli approvvigionamenti, le due principali sfide restano la forte dipendenza da fornitori extra-UE e la crescente complessità delle catene globali.
Nonostante i sistemi di qualifica e auditing periodico dei fornitori siano ormai prassi diffusa, le criticità persistono. Tra le misure proposte:
- diversificazione delle fonti di approvvigionamento;
- rafforzamento delle relazioni collaborative tra fornitori, produttori e distributori;
- piani strutturati di business continuity e gestione integrata delle scorte critiche;
- inserimento della “continuità di fornitura” come elemento chiave nei Quality Agreement.
Sul fronte logistico, le carenze possono derivare da una gestione non ottimale della catena del freddo, dall’uso di mezzi inadeguati o da una documentazione insufficiente sulle condizioni di trasporto e stoccaggio. Le contromisure includono la validazione dei trasporti, la selezione di vettori qualificati, piani di manutenzione e calibrazione dei mezzi e il monitoraggio continuo della distribuzione.
Nel campo Regolatorio e Quality Assurance, le cause più frequenti di carenza riguardano: non conformità delle materie prime o dei principi attivi, risultati fuori specifica sul prodotto finito, controlli non armonizzati lungo la filiera e lentezza dei processi autorizzativi.
Un caso emblematico è quello del 2018, quando la presenza di impurità nitrosaminiche in diversi principi attivi portò alla sospensione dei CEP di varie aziende produttrici, con gravi ripercussioni su disponibilità e tempi di fornitura [6].
La lezione è chiara: la diversificazione delle fonti di approvvigionamento, unita a strategie proattive di gestione del rischio e piani alternativi predefiniti, rappresenta oggi un vantaggio competitivo concreto.
Infine, le carenze legate alla produzione derivano spesso da inefficienze strutturali o organizzative: impianti obsoleti, ritardi nei piani di manutenzione, eccessiva concentrazione su prodotti ad alta marginalità a scapito dei farmaci essenziali. Servono quindi misure strategiche (fermi programmati, aggiornamenti tecnologici) e operative (scorte strategiche) per garantire la continuità produttiva.
Conclusioni
Il settore farmaceutico si trova oggi a gestire sfide complesse e scenari imprevedibili. Tuttavia, come dimostra questo studio, la consapevolezza delle proprie vulnerabilità può diventare il punto di partenza per costruire un futuro più resiliente e competitivo.
Affrontare il risk management in modo strutturato e proattivo non solo riduce le interruzioni impreviste e migliora l’efficienza produttiva, ma rafforza anche la fiducia di clienti, partner e autorità. Comprendere i rischi e adottare misure di mitigazione efficaci significa poter reagire con rapidità ai cambiamenti e, soprattutto, saperli anticipare.
Il percorso delineato – analisi, misurazione, definizione delle azioni e monitoraggio dell’efficacia – è una vera e propria call to action per l’industria farmaceutica: un metodo concreto per trasformare la vulnerabilità in consapevolezza e la consapevolezza in azione.
Perché, in un mondo in cui l’incertezza è diventata la nuova normalità, il vero vantaggio competitivo non è più saper reagire: è essere pronti a guidare il cambiamento.
—
Autori:
Ana Ambrona, Jazz Healthcare Italy S.r.l.
Andrea Mezzelani, Zentiva Italia S.r.l.
Denise Mori, GIF Associate
Donato Migliarino, Farmaceutici Formenti S.p.A. (Grünenthal Group)
Ivan Belloni, Valpharma International S.p.A.
Rita Brusa, AFI
Silvia Sanzone, Industria Farmaceutica Galenica Senese
Tania Perfetti, Ingenus Pharmaceuticals GmbH
Riferimenti:
[1] Senate Act. 1184 – XIX Legislature (Simplification of economic activities year 2025 approved on October 08, 2025
[2] https://health.ec.europa.eu/consultations/stakeholders-consultation-eudralex-volume-4-good-manufacturing-practice-guidelines-chapter-1_en
[3] Socal, M. P., et al. (2021). Gaps in Pharmaceutical Production and Distribution. PMC – National Institutes of Health.
[4] International Transport Forum – OECD. The Red Sea Crisis: Impacts on Global Shipping. Marzo 2024
[5] EMA, “Good Practices for Industry: Prevention of Human Medicinal Product Shortages” (2023)
[6] Regulation of Nitrosamine Impurities in Pharmaceutical (GMP-Platform) – 2024/09/24


