Negli ultimi anni la medicina basata sulla conoscenza e sul trattamento dei pazienti, riconosciuti come individui con caratteristiche uniche, si è concentrata principalmente sulla caratterizzazione delle loro “unicità” biologiche, definite dai cosiddetti dati –omici. Tale approccio, noto come medicina di precisione, è stato oggetto di un famoso discorso nel 2015 di Barack Obama. La medicina di precisione rappresenta, in sostanza, l’adattamento del trattamento medico alle caratteristiche individuali di ogni paziente. L’obiettivo è quello di rendere il processo di cura mirato a una determinata persona, al fine di aumentarne l’efficacia e diminuire le complicanze, gli insuccessi e gli sprechi economici. Un altro nome per questo è approccio è personomica.
Personomica
L’utilizzo delle informazioni fornite dai dati -omici nella diagnosi e nella cura dei pazienti ha un enorme potenziale per migliorare la salute umana. Tuttavia, il concetto di medicina di precisione tipicamente non prende in considerazione aspetti di variabilità individuale legati alle esperienze di vita della persona stessa. È qui che entra in gioco la personomica. Il termine è stato coniato sempre nel 2015 e proposto alla comunità scientifica da Roy Ziegelstein della Johns Hopkins University School of medicine tramite le colonne di Jama International Medicine.
La personomica determina come la malattia si rivela fenotipicamente e il modo in cui la patologia e l’individuo affetto rispondono al trattamento. In sostanza, tiene conto degli aspetti sociali, psicologici, culturali, comportamentali, dei fattori economici che influenzano le convinzioni sulla salute del paziente e delle sue interazioni con gli operatori sanitari. Con la personomica si dà importanza alle preferenze personali dell’individuo, ai suoi valori e obiettivi e al supporto che il paziente riceve dagli affetti.
Medicina personalizzata vs medicina di precisione
La medicina di precisione caratterizza gli individui sulla base di aspetti biologici e molecolari che possano targettizzare il processo di cura. Parte da grandi set di dati, derivati dalle scienze -omiche e dalle tecnologie a supporto, per ottenere diagnosi e terapie su misura.
La medicina personalizzata considera il profilo biologico del paziente, il suo stile di vita e l’influenza dei fattori ambientali, senza necessariamente basarsi su grandi set di dati per ridefinire la malattia.
Diagnostica di precisione
Come detto, con l’avvento delle scienze -omiche è diventato possibile raccogliere dati sul DNA, sull’mRNA, sulle proteine, sul metabolismo e sulla risposta ai farmaci. Gli attuali tool tecnologici e lo sviluppo di test a livello cellulare, come saggi genetici rapidi e sensori da indossare, permettono inoltre di integrare i dati -omici con altre informazioni cliniche, sullo stile di vita e sull’aderenza ai trattamenti. Il processo di conoscenza e applicazione dei risultati è circolare. I grandi set di dati biologici e ottenuti dalla digital health si integrano in una rete di conoscenze che alimenta sia le informazioni utili per l’evoluzione della scienza sia le informazioni utili per la gestione e il trattamento del singolo individuo.
La medicina genomica ha un impatto importante in tutte quelle condizioni in cui la presenza di mutazioni ha un ruolo causale.
In campo oncologico, per fare un esempio, la ricerca di oncogeni driver della malattia è sempre più usuale per costruire un processo di cura mirato e “aggiustare il tiro” in corso d’opera. I metodi di analisi sono diversi e possono essere applicati su un campione biologico ottenuto da una biopsia del tessuto indagato, oppure dalla più innovativa biopsia liquida, ovvero sul sangue. Quest’ultima ha il vantaggio di non essere invasiva e altamente ripetibile, permettendo di di monitorare nel tempo le evoluzioni della malattia. In questi casi si va a ricercare il DNA tumorale rilasciato nel torrente ematico dai tumori primari e dalle metastasi. Attualmente sono anche in studio altri approcci non invasivi su fluidi biologici diversi dal sangue per rintracciare, oltre al DNA tumorale circolante, anche cellule tumorali circolanti o exosomi.
Tecnologie a supporto
- Immunoistochimica: l’antigene di interesse è ricercato in una porzione di tessuto sulla base di reazioni antigene-anticorpo.
- Ibridazione fluorescente in situ: specifiche sequenze di DNA sono individuate a partire da campioni biologici diversi tramite sonde nucleotidiche marcate.
- Next generation sequencing: milioni di frammenti di acidi nucleici sono sequenziati in parallelo in tempi ridotti. Rappresenta la tecnica con maggiore potenziale e si applica anche alla biopsia liquida.
Il contributo dei Big Data
Negli ultimi anni abbiamo assistito a una vera e propria esplosione di volume, velocità e varietà delle informazioni disponibili in campo medico: i cosiddetti Big Data. Si tratta di una collezione di dati biologici, biometrici ed elettronici di milioni di individui la cui interpretazione può fornire importanti basi per l’interpretazione dei risultati ottenuti, per la previsione dei processi futuri e per l’individuazione di terapie ad hoc. L’intelligenza artificiale (AI) e il machine learning sono entrambi applicabili alla medicina di precisione. L’obiettivo? Andare oltre all’attuale capacità informativa dei Big Data e trovare il modo di comprendere i dati anche al fine di ottenere un valore pragmatico per la pratica clinica.
Quando si parla di tecnologie e medicina va ricordato che gli sforzi non sono esclusivamente di convalida dei processi. L’attenzione è infatti puntata anche sulle questioni di sicurezza, etiche e di privacy.
Applicazioni cliniche dell’AI e del machine learning
Intelligenza artificiale
- Raccolta, archiviazione, normalizzazione e tracciamento dei dati
- Monitoraggio continuo della terapia farmacologica
- Aderenza terapeutica
Machine learning
- Individuazione di una linea di condotta senza richiedere istruzioni dirette
- Gestione delle combinazioni farmacologiche
- Sviluppo di biomateriali
- Monitoraggio dinamico e continuo della patologia
- Aderenza terapeutica
Una nuova era per la ricerca clinica
L’attuale modello di disegno e sviluppo di uno studio clinico rischia di non essere più adeguato al momento storico. Se infatti è vero che, grazie alla ricerca e all’individuazione di sempre più marcatori biologici, si può individualizzare il processo di cura, è altrettanto vero che un disegno di uno studio clinico che non tiene conto di questa caratterizzazione della malattia rischia di non arrivare all’obiettivo: quello della cura “su misura”.
In pratica, attraverso una progressiva segmentazione, anche tumori frequenti sono trattati oggi come malattie rare e ciò rende poco applicabile il classico trial clinico randomizzato. Per questo sono stati proposti nuovi disegni, i cosiddetti master protocol, che includono i basket trial, gli umbrella trial e i platform trial e hanno l’obiettivo di trovare il trial giusto per il singolo paziente. Per farlo integrano nel trial anche realtà emergenti come il machine learning, il comprehensive molecular profiling e i dati di real world. L’enfasi sul ruolo dei biomarcatori in questi protocolli richiede un processo di screening sicuro e accurato.
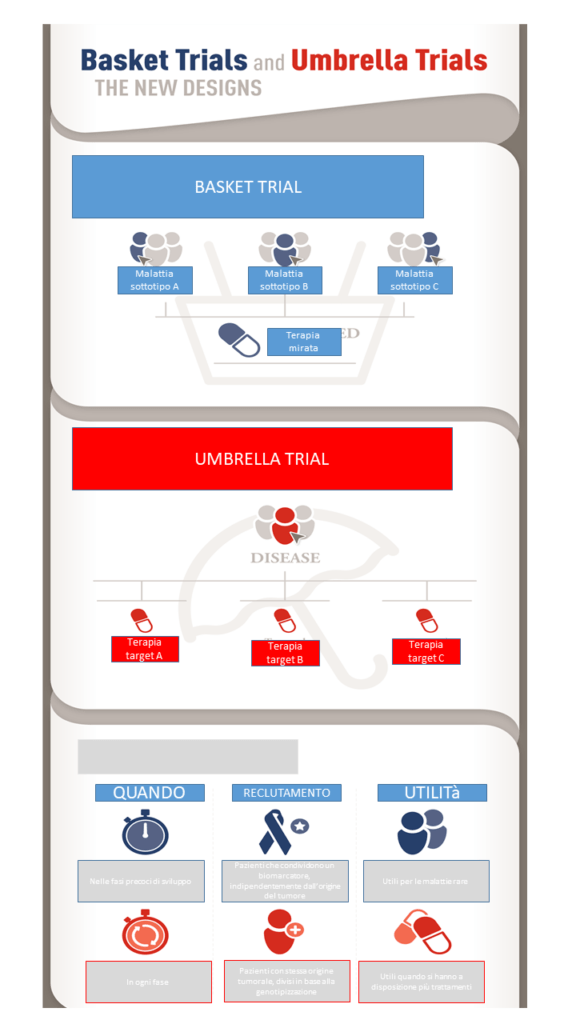
Umbrella trial
Negli umbrella trial applicati al campo oncologico, i pazienti con un tipo di tumore (in altre parole con lo stesso organo d’origine) sono esaminati per la presenza di una serie di biomarcatori. Su questa base vengono allocati ai bracci di trattamento con i farmaci corrispondenti, in cui ciascun farmaco è accoppiato allo specifico biomarcatore. Sono indicati in particolare nei casi in cui esistono diverse opzioni terapeutiche. Lo studio “ad ombrello” valuta anche l’efficacia del farmaci sul tipo di tumore individuale. La genotipizzazione del tumore suddivide i pazienti sulla base delle mutazioni per valutare le terapie target appropriate. I farmaci sperimentali possono essere valutati per diversi tipi di tumore con la stessa mutazione all’interno dello stesso studio o in un trial separato.
Basket trial
Nei basket trial applicati al campo oncologico, invece, i pazienti sono reclutati solo sulla base delle caratteristiche molecolari, indipendentemente dall’origine del tumore che non diventa quindi un criterio selettivo. Questa tipologia di studio risulta ideale per la valutazione mirata di terapie con target a bassa prevalenza. Il basket trial è indipendente dalla valutazione istologica e i bracci di trattamento si basano sulle mutazioni “condivise” dai pazienti. Le coorti di trattamento posso dunque essere più inclusive di mutazioni rare. Le risposte possono essere valutate per l’intera coorte o per le caratteristiche individuali.
Platform trial
In tutti questi studi si prevede anche di introdurre caratteristiche di disegni adattativi. In base ad essi, i risultati preliminari che via via vanno accumulandosi possono essere utilizzati per modificare il corso o la struttura del trial. Si tratta dei platform trial, studi in genere randomizzati, multi step e multi arm, con un braccio di controllo e più bracci sperimentali. L’applicazione è normalmente quella di valutare diverse terapie mirate per una o più malattie. Lo si fa attraverso appunto cambiamenti in corso di studio, con flessibilità in base all’andamento del trial. Oltre a ciò, anche altri aspetti di grande importanza devono essere considerati. Vanno dalla capacità di garantire l’integrità della condotta della sperimentazione clinica, a una robusta struttura in grado di interpretare in modo appropriato i risultati per l’applicazione nella pratica clinica.
Personomica, la medicina delle 5 P
Quando si parla di medicina personalizzata in campo oncologico, è inevitabile ricordare l’approccio 4P. La sigla si riferisce a un modello di cura predittivo, personalizzato, preventivo e partecipativo per il trattamento dei pazienti. Gabriella Pravettoni – professore ordinario di psicologia generale e direttore del dipartimento di oncologia ed emato-oncologia dell’Unimi, e direttore della divisione di psiconcologia allo IEO – in un passaggio del “Libro bianco sulla medicina personalizzata in oncologia” sottolinea però come sia altrettanto importante dare rilevanza alla componente psicologica. P non solo come “psicologia”, ma anche come “persona” con una serie di bisogni. La personomica, quindi. Purtroppo, sebbene siano passati ormai 10 anni dall’introduzione del concetto della medicina 5P, siamo ancora molto indietro su questo approccio.