bluebird bio ha presentato i risultati aggiornati sull’efficacia e la sicurezza a lungo termine che riflettono i dati fino a 6 anni di terapia genica con betibeglogene autotemcel (beti-cel) nei pazienti con β-talassemia trasfusione-dipendente (TDT). Inoltre, l’azienda ha presentato i risultati dei pazienti di età inferiore ai 18 anni negli studi di Fase 3 HGB-207 (Northstar-2) e HGB-212 (Northstar-3).
Dei 10 pazienti arruolati nello studio a lungo termine LTF-303 in corso dal programma di Fase 3, 9/10 (90%) hanno raggiunto l’indipendenza dalle trasfusioni (TI, definita come l’assenza di trasfusioni per almeno 12 mesi, mantenendo i valori medi di emoglobina pari o superiori a 9 g/dL) e rimangono tutti indipendenti dalle trasfusioni.
Negli studi di Fase 3, l’87% (13/15) dei pazienti di età inferiore ai 18 anni ha raggiunto l’indipendenza dalle trasfusioni con una mediana della media ponderata di emoglobina pari a 11,3 (9,4 – 12,8) g/dL e rimane libero da trasfusioni.
Nel follow-up a lungo termine, il 53% (9/17) dei pazienti che hanno raggiunto l’indipendenza dalle trasfusioni e avevano ripreso la chelazione del ferro da allora hanno interrotto la terapia; il 30% (7/23) dei pazienti che hanno raggiunto l’indipendenza dalle trasfusioni sono attualmente sottoposti a flebotomia per ridurre i livelli di ferro 1.
I dati sono resi noti nell’edizione virtuale del 62° Congresso Annuale della Società Americana di Ematologia (ASH), in corso fino all’8 dicembre 2020.
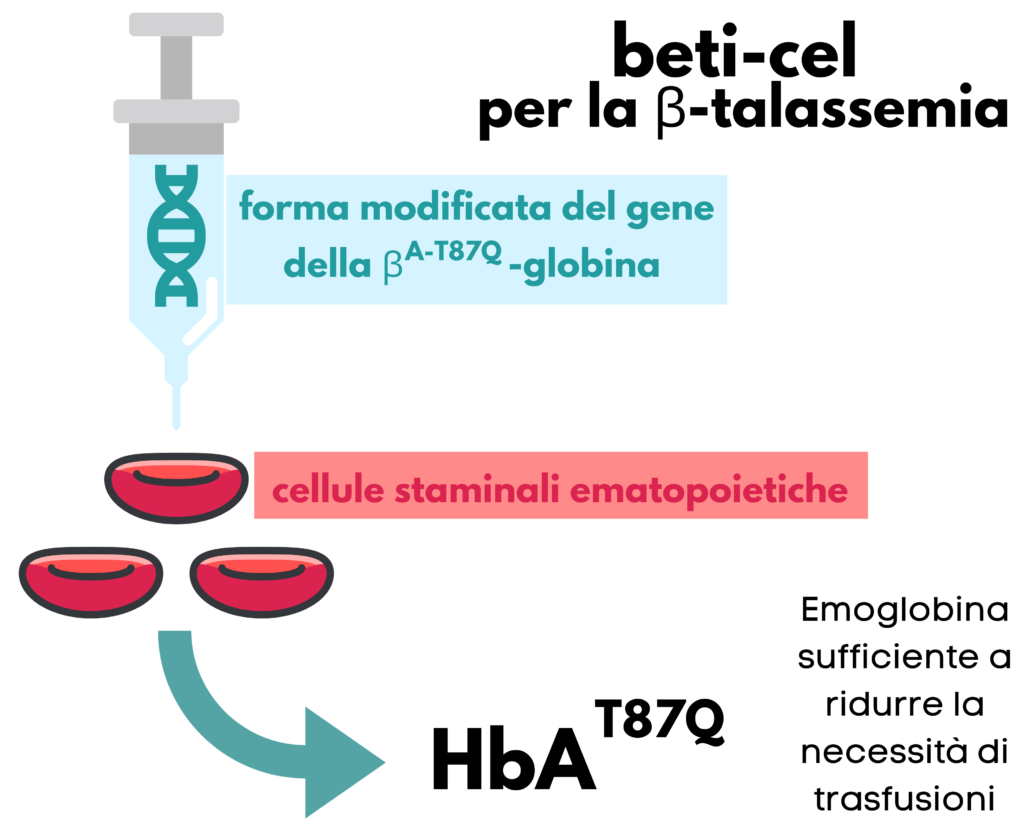
Betibeglogene autotemcel (Beti-cel)
Beti-cel è una terapia genica una tantum sviluppata per aggiungere copie funzionali di una forma modificata del gene della βA-T87Q-globina nelle cellule staminali ematopoietiche (CSE) del paziente stesso. Una volta introdotto il gene della βA-T87Q-globina, il paziente è potenzialmente in grado di produrre HbAT87Q, un’emoglobina derivata dalla terapia genica, in quantità tale da eliminare o ridurre significativamente la necessità di trasfusioni.
La CE ha concesso la CMA (autorizzazione condizionata all’immissione in commercio) per betibeglogene autotemcel (beti-cel; in precedenza terapia genica LentiGlobin™ per la β-talassemia), per pazienti di età pari o superiore a 12 anni con TDT e con genotipo non β0/β0, per i quali il trapianto di cellule staminali ematopoietiche (CSE) è appropriato, ma non sia disponibile un donatore di CSE consanguineo compatibile per l’antigene leucocitario umano (HLA).5 Il 28 aprile 2020, l’Agenzia Europea per i Medicinali (EMA) ha rinnovato la CMA, supportata dai dati di 32 pazienti trattati con beti-cel, tra cui tre pazienti con un follow-up fino a cinque anni.
La CMA è valida nei 27 Stati membri dell’UE, nonché nel Regno Unito, in Islanda, nel Liechtenstein e in Norvegia. Per maggiori dettagli, consultare il Riassunto delle Caratteristiche del Prodotto (RCP).5 La U.S. Food and Drug Administration (FDA) ha concesso a beti-cel lo status di Farmaco Orfano e la designazione di Terapia Innovativa (Breakthrough Therapy) per il trattamento della TDT. Beti-cel non è approvato negli Stati Uniti.
Studi su Beti-cel per la β-talassemia
Negli studi su questa terapia genica, l’indipendenza dalle trasfusioni è definita come la mancanza della necessità di ricevere trasfusioni per almeno 12 mesi, mantenendo un valore medio ponderato di emoglobina pari ad almeno 9 g/dL.
Al 3 marzo 2020, un totale di 60 pazienti, tra cui 10 pazienti con almeno 5 anni di follow-up e 1 paziente con almeno 6 anni, con diversi genotipi di TDT sono stati trattati con questa terapia genica negli studi:
- HGB-204 (Northstar) di Fase 1/2,
- HGB-205 di Fase 1/2,
- HGB-207 (Northstar-2) di Fase 3 ,
- HGB-212 (Northstar-3) di Fase 3.
Dati di efficacia nello studio di follow-up a lungo termine LTF-303
Dopo aver partecipato e completato i due anni di follow-up in uno degli studi di Fase 1/2 (HGB-204, HGB-205), o negli studi di Fase 3 (HGB-207, HGB-212), i pazienti trattati con questa terapia genica sono stati invitati ad arruolarsi nello studio di follow-up a lungo termine di 13 anni, LTF-303.
Al 3 marzo 2020, 32 pazienti sono stati arruolati nell’LTF-303 (22 trattati negli studi di Fase 1/2, 10 trattati negli studi di Fase 3) con un follow-up post infusione mediano di 49,1 mesi (min-max: 23,3 – 71,8 mesi).
Tra i 32 pazienti arruolati nell’LTF-303, la TI è stata raggiunta da 14/22 (64%) pazienti trattati negli studi di Fase 1/2 e da 9/10 (90%) pazienti trattati negli studi di Fase 3. Tutti i pazienti che hanno raggiunto la TI sono rimasti liberi da trasfusioni [la durata media della TI in corso è di 39,4 mesi (min-max: 19,4 – 69,4 mesi)].
La media ponderata dell’emoglobina (Hb) per i pazienti che hanno raggiunto la TI in Fase 1/2 è risultata pari a 10,4 (min-max: 9,4 – 13,3) g/dL e a 12,5 (min-max: 11,9 – 13,5) g/dL per i pazienti che hanno raggiunto la TI negli studi di Fase 3.
Prima dell’infusione della terapia genica, tutti i pazienti ricevevano la terapia ferrochelante, necessaria per ridurre l’eccesso di ferro causato dalle trasfusioni di sangue croniche. Tra i 23 pazienti che hanno raggiunto la TI dopo il trattamento con la terapia genica, la maggior parte (65%, n=15) ha interrotto la terapia ferro-chelante e il 30% (7/23) ha potuto sottoporsi alla flebotomia (rimozione del sangue), un metodo preferibile per la riduzione del ferro.
Dati di sicurezza nello studio di follow-up a lungo termine LTF-303
Nell’LTF-303, tutti i pazienti sono risultati vivi all’ultimo follow-up e non sono stati osservati casi di lentivirus competente per la replicazione, oncogenesi inserzionale o dominanza clonale. Non sono stati segnalati eventi avversi severi (EA) associati al farmaco a più di 2 anni dopo l’infusione.
Gli eventi avversi seri (SAE) durante lo studio LTF-303 non correlati alla terapia genica hanno compreso insufficienza gonadotropica, gravidanza ectopica, ispessimento della parete della cistifellea/polipi, batteriemia, neutropenia e depressione maggiore (n=1 per ognuno di essi).
Sicurezza di betibeglogene autotemcel (beti-cel) in altri studi
Altri EA osservati negli studi clinici sono stati coerenti con gli effetti collaterali noti della mobilizzazione delle cellule staminali ematopoietiche (HSC) e dell’ablazione del midollo osseo con busulfano, inclusa la malattia veno-occlusiva epatica.